
DDS烟道气脱硫技术
作者/来源:北京博源恒升高科技有限公司 日期:2012-05-15 点击量:789
1、DDS脱硫技术用于烟道气脱硫的实验方案(副产硫酸盐方案)
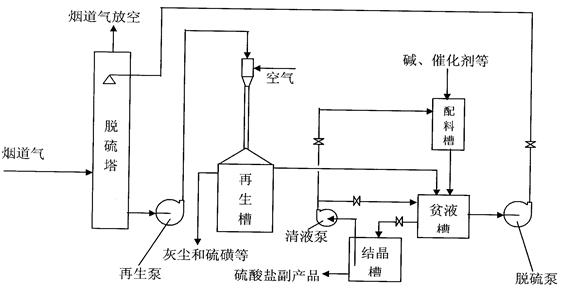
“DDS烟道气脱硫技术”是用含DDS催化剂的碱性水溶液(简称为“DDS溶液”)吸收烟道气中的二氧化硫、三氧化硫及少量硫化氢的一种全新的湿法生化脱硫技术。
吸收了硫的DDS溶液称为“富液”, “富液”在DDS催化剂的催化下,用空气氧化再生,副产品硫酸盐和少量硫磺(可以回收);再生后的DDS溶液称为“贫液”, “贫液”全循环使用。本技术的特点是能够将烟道气中的总硫含量降至10毫克/标准立方米烟道气以下,脱硫效率可达99%以上,无二次污染,并且本脱硫液具有防腐能力,对设备腐蚀轻。
吸收反应:
SO2 + Na2CO3  Na2SO3 + CO2
Na2SO3 + CO2
 Na2SO3 + CO2
Na2SO3 + CO2
SO3 + Na2CO3 Na2SO4 + CO2
Na2SO4 + CO2
 Na2SO4 + CO2
Na2SO4 + CO2
再生反应:
2Na2SO3 + O2 2Na2SO4
2Na2SO4
 2Na2SO4
2Na2SO4
1-1、中试实验流程

1-2、中试实验结果和生产实验工艺指标
实验烟气量为400~600m3/hr,中试实验结果列入表一
表一:烟道气脱硫中试实验结果
|
烟道气进口硫含量
mg/m3
|
烟道气出口硫含量
mg/m3
|
脱硫效率
%
|
连续运行时间
(天)
|
|
≥2000
|
≤2
|
≥99.9
|
30
|
|
30天内产生硫酸盐量(主要是硫酸钙)(Kg)
|
约1200
|
||
|
消耗DDS催化剂量(Kg)
|
1(配方用除外)
|
||
中试实验结果表明,“DDS烟道气脱硫技术”脱硫效率高达99.9%,而且综合运行成本低。因此,“DDS烟道气脱硫技术”具有非常广泛的应用和推广前景。有必要进一步进行实际生产实验,以便本技术能够真正转入实际的生产运用。生产工艺指标如下:
烟道气脱硫前温度:90~170℃;
烟道气脱硫后温度:70~90℃;
溶液组成根据进出口二氧化硫的含量来确定。
为了慎重起见,我们必须按照以上的实验方法,重复进行实验,但是实验的副产物是硫酸钙,而是做成元明粉(硫酸钠),因为元明粉是一种化工原材料,具有广大的市场。
2、DDS脱硫技术用于烟道气脱硫的实验方案(副产二氧化硫方案)
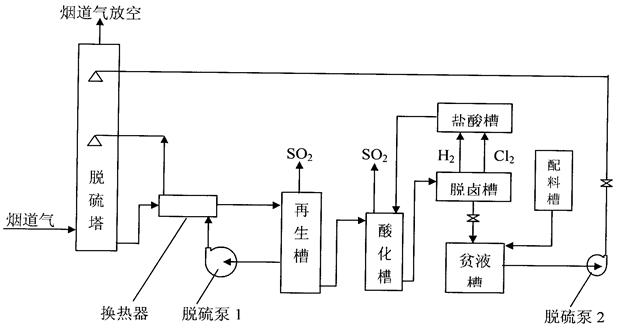
DDS脱硫技术用于烟道气脱硫,如果需要的副产物不是硫酸盐,而是二氧化硫时,其吸收部分和副产硫酸的工艺设备一样,但是再生流程和再生方法却完全不一样。其基本原理如下:
吸收反应:
SO2 + 2NaOH Na2SO3 + H2O
Na2SO3 + H2O
 Na2SO3 + H2O
Na2SO3 + H2O
SO3 + 2NaOH  Na2SO4 + H2O
Na2SO4 + H2O
 Na2SO4 + H2O
Na2SO4 + H2O
SO2 + H2O + Na2SO3 2NaHSO3
2NaHSO3
 2NaHSO3
2NaHSO3
再生反应:
2Na2SO4  2Na2SO3 + O2
2Na2SO3 + O2
2NaHSO3 Na2SO3 + SO2 + H2O
Na2SO3 + SO2 + H2O
 Na2SO3 + SO2 + H2O
Na2SO3 + SO2 + H2O
Na2SO3 + 2HCl  2NaCl + SO2 + H2O
2NaCl + SO2 + H2O
 2NaCl + SO2 + H2O
2NaCl + SO2 + H2O
2NaCl + 2H2O  2NaOH + H2 + Cl2
2NaOH + H2 + Cl2
 2NaOH + H2 + Cl2
2NaOH + H2 + Cl2
H2 + Cl2  2HCl
2HCl
 2HCl
2HCl
2-1、实验流程

2-2、实验工艺指标:
烟道气脱硫前温度:90~170℃;
烟道气脱硫后温度:70~90℃;
脱硫效率:大于90%。
溶液组成根据进出口二氧化硫的含量来确定。
参考文献
[1] Benson, H.E. Parrish, R.W. (1974) HiPure Process Removes CO2/H2S. Hydrocarbon Processing, April. 81-82.
[2] Jenett, E. (1962), Giammarco-Vetrocoke Process. The Oil and Gas Journal. April 30, 72-79.
[3] 魏雄辉, (1994) 半水煤气脱硫脱氧新方法,中国专利 CN1087110。
[4] 魏雄辉, (1996) 加压铁—碱溶液脱碳脱硫,中国专利 CN1133817。
[5] 魏雄辉,戴乾圜,陈忠明,邵可声,张晨鼎,(1998) 碱性铁盐缓冲水溶液脱硫法原理,化工学报, 49(1), 48-58。
[6]West, R. C. (1989) CRC Handbook of Chemical and Physics 70th, ppD-1~ppD-337. CRC Press Inc., Boca Raton, Florida.
[7]Dean, J. A. (1972), Lange's Handbook of Chemistry 13th, pp9-1~pp9-190. McGraw-Hill Book Company, New York.
[8] 黄子卿, (1983)《电解质溶液导论》,中国科学技术出版社,北京。
[9]Tangerman, A. (1986) Determination of Volatile Sulphur Compounds in Air at the Parts Per Trillion Level By Tenax Trapping and Gas Chromatography. J. of Chromatography. 366, 205-216.
[10]Shigeki, Abe. Suda, T. S. M. (1986) Simultaneous Determination of Iron (Ⅱ) and Iron (Ⅲ) in Aqueous Solution by Kinetic Spectrophotometry with Tiron. Anal. Chimica Acta. 181,203-209.
[11] Kokkonen, P. Hyvarinen, H. (1988) Determination of Sulfur Anions by High-performance Liquid Chromatography. Anal. Chimica Acta. 207, 301-306.